Věděli jste o reakci Svatého grálu v chemii?
April 22, 2024
Pokud jde o zemní plyn, nesmíte s ním být obeznámeni a v dnešní době bez něj žádná domácnost nemůže vařit. Hlavní složkou zemního plynu je metan, což je jedna z nejjednodušších uhlovodíkových sloučenin. Zrychlení vývoje a využití metanu je klíčem k realizaci zeleného a udržitelného rozvoje energetického a chemického průmyslu. Kromě jeho přímého použití jako paliva lze metan také použít jako zdroj C1, tj. Molekula, která obsahuje atom uhlíku a může být i nadále převedena tak, aby připravila chemikálie s vysokou hodnotou, jako je methanol, formik kyselina a tak dále. Metan může být spálen v kyslíku za vzniku vody a oxidu uhličitého. Bez spalování je možné aktivovat a převést uhlovodíkové vazby molekul metanu za mírných podmínek? Odpověď je ano! Toto je reakce „svatého grálu“ v oblasti katalýzy. Reakce spojené s „svatým grálem“ jsou často velmi náročné, protože možná je třeba provádět za velmi tvrdých podmínek, nebo možná budou muset překonat vlastní obtíže chemické reakce, jako je aktivace vysoce stabilních sloučenin, nízké, nízké výnosy a nízká selektivita. Tyto výzvy ztěžují realizaci těchto reakcí, ale pokud je lze úspěšně dosáhnout, povedou k významným průlomům ve vědeckém výzkumu a průmyslových aplikacích.

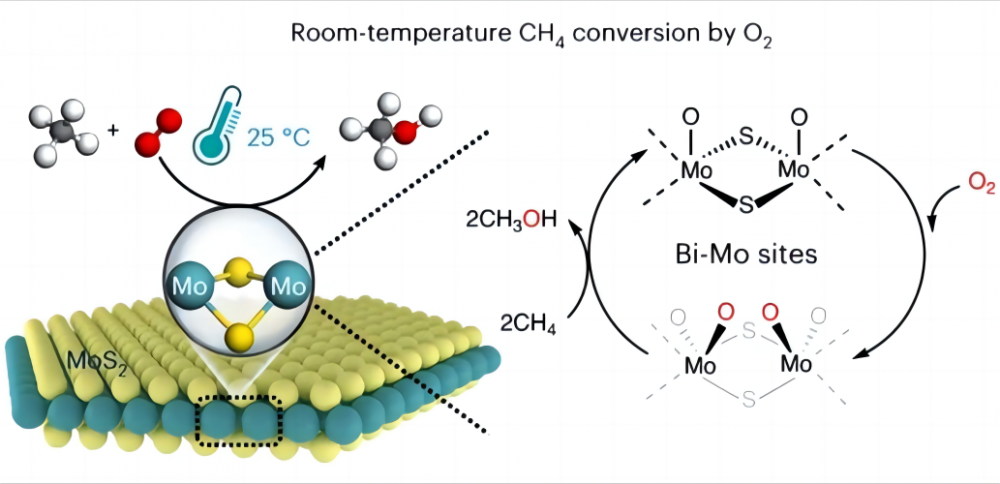
1. Bladlí při přeměně metanu při nízkých teplotách Je velmi obtížné převést metan přímo na jiné užitečné chemikálie s levným kyslíkem při nízkých teplotách nebo dokonce pokojové teplotě, proč je to? Podívejme se na povahu metanu a kyslíku. Chemická struktura metanu obsahuje čtyři identické vazby uhlíku-hydrogen (CH), které tvoří vysoce symetrickou ortotetrahedrální konfiguraci, a každá vazba metanu CH3-H má energii vazeb až 435 kJ/mol. Můžeme myslet na CH vazbu metanu jako na obzvláště silnou pramen. Letos na jaře je velmi napjatá a vyžaduje protažení velké síly. V chemii je tato „síla“ energie potřebná k přerušení CH vazby. Tato vysoká vazebná energie způsobuje, že metanové CH vazby termodynamicky stabilní a velmi obtížně se rozbijí nebo reagují za normálních podmínek. Na druhé straně, v chemických reakcích jsou reaktivní skupiny obvykle generovány pod polární interakcí (polární interakce je jev, který má molekula jeden konec pozitivně nabitý a druhý negativně nabitý), zatímco symetrická struktura a nepolární povaha molekuly metanu prevence To z generování takové polarity (podle molekulární konfigurace nemá molekula se symetrickou rovinou žádnou polaritu) a nemůže poskytovat reaktivní skupiny. Proto je aktivace a přeměna metanu velmi náročná a obvykle vyžaduje tvrdé podmínky, jako jsou vysoké teploty (600-100 ° C) nebo některé „extrémofily“, jako jsou super-silné kyseliny a volné radikály, které pomáhají při aktivaci metanu. Hlavní obtížnost při realizaci nízkoteplotní aktivace metanu a kyslíku spočívá v tom, jak aktivovat CH vazbu metanu, tj., Jak natáhnout „pružinu“ v CH vazbě. 2. Zázrak katalyzátoru Vědci přišli s dobrým řešením tohoto problému a rozhodli se použít katalyzátor k aktivaci metanu při nízkých teplotách (katalyzátor je chemikálie, která se nemění před nebo po reakci, ale zrychluje reakci změnou minimálního množství energie, kterou je třeba injikovat, aby se reakce odehrála). V roce 2023 se katalýza přírody časopisu hlásila o procesu dosažení přímé přeměny metanu s kyslíkem na oxidy C1 (methanol (CH3OH), kyselina mravenčí (HCOOH) a methylenglykol (HOCH2OH)) s použitím specifického molybdenového disulfidu (MOS2) Katalyzátor při 25 ° C. Konverze metanu 4,2% a téměř 100% oxygenates C1 byla dosažena změnou methanu a kyslíku na cenné okysličení C1 za okolních podmínek. Tento MOS2 je jediným dosud uváděným katalyzátorem, který může realizovat přeměnu teploty místnosti metanu a kyslíku. To vše je způsobeno jedinečnou geometrií a elektronickou strukturou místa MO na okraji MOS2. Toto místo MO má vysokou aktivační aktivitu vůči kyslíku ve vodném prostředí a vytváří magické druhy O = MO = O*. Tento druh usnadňuje prolomení a snižuje aktivační energii metanu, čímž výrazně zvyšuje reaktivitu metanu, a tak si uvědomí aktivaci methanu a kyslíku a snižuje aktivační energii metanu. Tento objev přinese více možností pro budoucí využití energie a ochranu životního prostředí a také nám poskytne hlubší pochopení úžasné role katalyzátorů a pomocných společností.
3. Nevýznamný strategický význam aktivace metanu s nízkou teplotou Realizace přímé katalytické přeměny metanu a kyslíku při teplotě místnosti a přeměny metanu v zemním plynu na jiné užitečné chemikálie, může výrazně zlepšit míru využití zemního plynu, snížit odpad a lépe chránit životní prostředí a realizovat udržitelný rozvoj energie a uvědomit si udržitelný rozvoj energie a uvědomit si udržitelný rozvoj energie . Za druhé, jako skleníkový plyn je metan na druhém místě oxidu uhličitého ve svém příspěvku k globálnímu oteplování. Pokud může být metan přeměněn na jiné látky, může nám pomoci snížit emise znečišťujících látek ovzduší (např. Oxidy uhličitého, oxidy dusíku, oxidy síry, uhlovodíky a éter sloučeniny) a zmírnit tlak globálního oteplování.




